南京大学生命科学学院张辰宇、陈熹、王延博教授,医学院方雷教授等人通过研究揭示了一项重大发现:年轻血液中的小细胞外囊泡(sevs)具有显著延长寿命、恢复整体生理功能以及逆转与年龄相关的退化变化的能力。
衰老是一个不可避免的时间依赖性过程,最终限制了细胞维持有效内稳态和修复机制的能力,导致全身生理功能普遍下降。衰老相关慢性疾病(例如心血管疾病、糖尿病、神经退行性疾病以及癌症)给医疗卫生系统带来巨大负担。因此,了解衰老的基本机制,制定衰老及其相关疾病的防治策略是非常必要的。
在机制上,衰老过程主要归因于细胞、细胞器和大分子中随机损伤的逐渐积累。损伤的确切机制尚不完全清楚,但可能包括几个细胞自主过程,包括基因组不稳定、端粒损耗、表观遗传改变、蛋白酶稳态丧失、营养感知失调、线粒体功能障碍、细胞衰老和干细胞耗竭等。然而,非细胞自主机制,特别是细胞、组织和器官之间相互作用的改变,对衰老也至关重要。
血液中存在的环境因素促进了组织和器官之间的有效相互作用,对维持全身健康状态至关重要。因此,年龄相关的疾病恶化也被认为是由组织通讯障碍引起的,而血液循环中的分子是主要促发因素。
在南京大学学者最新的研究中,研究团队聚焦于直径<200纳米的小细胞外囊泡(sev),并通过将来自年轻小鼠或人类的sev重复注射给老年小鼠,探索它们的“返老还童”作用。通过体内和体外模型,该研究进一步阐明了年轻的sev在逆转年龄相关损伤和退行性变化中的关键作用的分子基础。
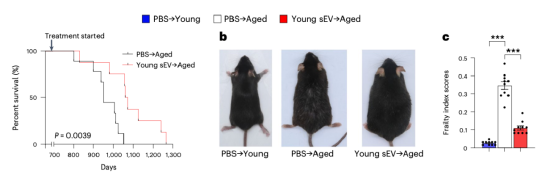
具体来说,来自年轻血浆的小细胞外囊泡(sev)在分子、线粒体、细胞和生理水平上对抗预先存在的衰老。将年轻的sev静脉注射到老年小鼠体内可延长其寿命,减轻衰老表型,并改善与年龄相关的多个组织的功能衰退。每周向20月龄的老年雄性小鼠注射年轻的sev,可使其中位寿命延长至1031天,比c57bl/6j雄性小鼠通常840天的寿命延长了22.7%。其中最长寿的小鼠存活了1266天,相当于人类的120-130岁。这一延长寿命的效果超过了热量限制饮食、二甲双胍及烟酰胺的效果。
定量蛋白质组学分析发现,年轻sev治疗后老年组织的蛋白质组发生了显著变化,这些变化与代谢过程密切相关。从机制上来说,年轻的sev通过其携带的mirna货物在体外和体内刺激pgc-1α的表达,从而改善线粒体功能和减轻老年组织的线粒体缺陷。pgc-1α是线粒体稳态的关键调节因子,通过协调细胞核基因组和线粒体基因组编码的线粒体蛋白的表达来增强线粒体生物发生,并通过调节线粒体质量控制和促进线粒体再生来维持线粒体数量和质量的稳定性。

总的来说,这项研究表明,年轻血浆中的sev在分子、线粒体、细胞和生理水平上抵消了已经存在的衰老,其至少部分通过刺激pgc-1α表达和增强线粒体能量代谢来逆转退行性改变和年龄相关的功能障碍。更重要的是,年轻的sev作为有前途的天然载体,可以稳定地递送“返老还童”因子,而不具有毒性或免疫原性,因此sev可作为一种多功能工具,帮助衰老组织恢复活力,改善终身健康和福祉。
相关研究成果于4月16日发表于国际顶级期刊《nature》的子刊《nature aging》上。南京大学陈骁锐、骆阳、朱卿、章竞子、黄欢为论文共同第一作者,南京大学陈熹、王延博、方雷、张辰宇为论文共同通讯作者。




